Установка Видеонаблюдения, Охранной и Пожарной сигнализации.
Звоните! Приедем быстро! Установим качественно! + гарантия 5 лет.
| Тел. ОАО «Охрана Прогресс» Установка Видеонаблюдения, Охранной и Пожарной сигнализации. Звоните! Приедем быстро! Установим качественно! + гарантия 5 лет. |
||
|
Установка технических средств охраны. Тел. . Звоните! Главная Свойства легированного феррита 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65 66 67 68 Как показано И. И. Корниловым, неограниченные твердые растворы на основе железа и других тугоплавких металлов образуются, если это различие не более ±8%. Следовательно, для твердых растворов на основе железа предельные колебания размерного фактора Гме, нм (±8% для неограниченных и ±151% для ограниченных твердых растворов), будут характеризоваться данными, представленными ниже: а- железо Неограниченный Ограниченный О, И4-0,134 0.105-0,143 у-железо 0,117-0,137 0,108-0,146 0,92-1,08 0,85-1,15 Примечание, г оый раднус легирующего элемента; гре- атомный раднус железа. Как видно из представленных данных, атомные размеры никеля, кобальта, марганца, хрома и ванадия отличаются от атомных размеров изоморфных с ними модификаций железа не более чем на 8 %, эти элементы с железом дают неограниченные твердые растворы. Ограниченные твердые растворы с широкой областью гомогенности дают эти же элементы с неизоморфными модификациями железа. Молибден и вольфрам, которые имеют размерный фактор за пределами 8% (соответственно 10 и 11%), образуют с обеими модификациями железа ограниченные растворы с широкой областью гомогенности. Элементы с атомным радиусом на пределе размерного фактора (титан, ниобий, тантал) образуют лишь ограниченные растворы с узкой областью гомогенности или практически нерастворимы в железе. Когда размерный фактор выходит за пределы 15 % (цирконий, гафний, свинец), элементы имеют незначительную растворимость в железе. Если размерный фактор находится в допустимых пределах и соблюдается условие изоморфности решеток (например, система Y-желе-30 - Си), значение предельной растворимости не всегда коррелирует с отклонением размеров атомов легирующего элемента от железа. В какой-то степени это может быть объяснено тем. что атомный размер не является постоянной характеристикой элемента. Атомный радиус железа и легирующего элемента в стали и сплаве может отличаться от тех же параметров в чистых металлах, которые указаны на рис. 13. Размеры атомов в твердых растворах характеризуются эффективным атомным радиусом. На с. 37 приведены значения эффективных атомных радиусов легирующих элементов в твердом растворе на основе а-железа. Значения атомных радиусов чистых металлов (гме по Гольд-шмидту при /С=8) и их эффективных атомных радиусов гме в твердом растворе на основе а-железа представлены ниже: Легирующий элемент . . ГМе ----
* в числителе - в нанометрах, в зиамеиателе - в процентах. Из Приведенных данных видно , что в сплавах на основе а-железа эффективный атомный радиус на 2-5 % отличается от атомного радиуса чистого металла. Чем более удален элемент от железа в периодической системе, тем больше эта разница. Эти отклонения могут внести определенные коррективы в размерный фактор. Однако размерный фактор является необходимым, но недостаточным условием, определяющим образование твердого раствора замещения. Значения предельной растворимости легирующих элементов в железе зависят от взаимного расположения этих элементов в периодической системе. Наибольшую растворимость в железе имеют элементы, находящиеся в том же периоде, что и железо, а также расположенные в наиболее близких к нему V-VIII группах. Как известно, по мере удаления от железа увеличивается различие в строении внешних й- и s-электронных оболочек d-переходных металлов, изменяется металлическая валентность и электрохимические свойства элементов, т.е. обычно говорят, что изменяется сродство к электрону. В свою очередь электронное строение определяет и атомные размеры элементов. Поэтому как размерный фактор, так и сродство к электрону являются связанными между собой параметрами, определяющими растворимость элементов в железе. Роль электронного строения компонентов при образовании твердых растворов на основе железа установлена далеко не однозначно, во всяком случае, электронная теория ограниченных твердых растворов в сплавах железа еще далека от подобной теории для твердых растворов на основе благородных металлов (электронные соединения на основе меди, серебра и золота). Роль сродства к электрону для твердых растворов в сплавах железа освещена в трудах В. К. Григоровича. Необходимо также отметить, что все рассмотренные выше закономерности образования твердых растворов на базе железа установлены для двойных систем железо-леги- рующий элемент. В реальных сталях и сплавах образуются многокомпонентные твердые растворы. Закономерности образования твердых растворов для конкретных многокомпонентных систем будут рассмотрены при изложении материалов по соответствующим легированным сталям. 2. Закономерности образования твердых растворов внедрения Твердые растворы внедрения образуют элементы внедрения с малыми атомными размерами. Значения атомных радиусов элементов внедрения приведены ниже: внедре- Элемент ния . . Тх, нм . 0,091 0,077 0,071 0,063 0,046 Твердые растворы внедрения являются частным случаем фаз внедрения (к последним также относятся карбиды, нитриды, бориды, оксиды, гидриды и другие химические соединения переходных металлов с элементами внедрения). Твердые растворы внедрения всегда ограничены, а растворимость в них зависит от кристаллической структуры металла-растворителя и размеров атома элемента внедрения. Ограниченность твердых растворов внедрения определяется тем, что они сохраняют решетку металла-растворителя, а атомы внедрения в них занимают лишь вакантные междоузлия - октаэдрические и тетраэдрические поры в решетке металла-растворителя. Часть пор всегда не заполнена. Размеры этих пор для о. ц. к., г. ц. к. и г. п. у. решеток представ(лены ниже, а на рис. 14 приведена схема расположения пор в а- и 7-железе: о. ц. к. г. ц. к. г. п. у. Октаэдрические поры..... 0,154гл, 0,41гд, 0,412гд, Тетраэдрические поры . ... 0,291лл 0.22., 0.222л, Примечание, rj - радиус атомов в узлах решетки металла-растворителя. Наиболее благоприятными позициями расположения атомов внедрения в твердом растворе будут октаэдрические поры в а-железе и окта- и тетраэдрические поры в 7-железе. Междоузлие обязательно должно быть меньше, чем размер атома внедрения, так как в противном случае : прочной связи между атомами металла-растворителя и атомами внедрения не будет. Однако размер поры не должен быть и слишком малым, так как внедрение атома вызовет ослабление связей между атомами решетки растворителя, и структура такого твердого раствора будет неустойчивой. Какая из пор является наиболее благоприятной для размещения в ней атома внедрения, будет определяться не только ее размерами, но и количеством соседних атомов. 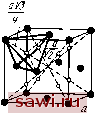  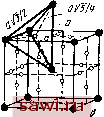 Рис. 14. Положение октаэдрнческнх (б, г) н тет-раэдрическнх пор в г. ц. к. (а, б) н о. ц. к. (в, г) решетках претерпевших деформацию при образовании твердого раствора внедрения. Так, в а-железе растворение углерода и азота происходит в октаэдрических порах, меньших по размеру, чем тетраэдрические, так как в первом случае сме-щаются два атома вдоль ребра куба в направлении с малой плотностью упаковки, а во втором - четыре атома в направлении плотной упаковки. Таким образом, энергия деформации о. ц. к. решетки от внедрения атомов углерода или азота в окта-пору будет меньше, чем при внедрении их в тетра-пору. Растворимость атомов внедрения увеличивается с уменьшением размера атомов, т. е. возрастает в ряду В -С - N - О - Н. Из перечисленных атомов внедрения наибольшее значение при рассмотрении легированных сталей имеют углерод и азот. Данные по их растворимости в а-железе приведены на рис. 15. Как видно, азот, имеющий меньший атомный радиус (0,071 нм), чем углерод (0,077 нм), рас- t,°c 700 BOO h 500 7Z3°C .Fe-C от \ .,r£ Fej J I-1- 2-10-° 0,1 C;N> Рис. 15. Температурная зависимость растворимости углерода (сплошные линии) и азота (штриховые линии) в а-железе творяется В а-железе в значительно большем количестве. В -у-железе максимальная растворимость азота также больше, чем углерода (2,8 и 2,0%, соответственно). Значительно большая растворимость углерода и азота в -же-лезе по сравнению с а-железом связана с тем, что в г. д. к решетке размер пор больше, а их число меньше, чем в о. д. к.-решетке, т. е. для а-железа характерна большая рыхлость упаковки. Необходимо также отметить, что значительная деформация решетки при внедрении атомов неметалла в пору решетки металла-растворителя приводит к тому, что значительное число пор не заполняется атомами внедрения. Так, при предельном насыщении углеродом Y-железа (до 2 % С) один атом углерода приходится на каждые три элементарных ячейки железа [~8% (ат.) С}, а для а-железа (0,018 % С) один атом углерода на 600 элементарных ячеек [0,083% (ат.) С]. Столь значительное различие растворимости углерода в двух moj дификадиях железа обусловливает возможность различной термической обработки сталей. Твердые растворы внедрения, как и все фазы внедрения, образуются при выполнении условия (правила Хэгга) где Гл: -радиус атома внедрения (неметалла); Гме-радиус атома-растворителя (металла). Это соотношение выполняется, если в расчет принимаются эффективные радиусы элементов. Указанные выше значения атомных радиусов элементов внедрения могут сильно отличаться от эф(>ективных радиусов тех же элементов, находящихся в твердом растворе. Так, на основе измерения параметров твердых растворов внедрения и последующих расчетов установлено, что эффективный радиус атомов углерода (г*) в 7-железе равен 0,068 нм (вместо Гс = 0,077 нм), а га?*=0,073 нм (вместо rjv=0,071 нм). Следовательно, правилу Хэгга соответствует отношение га**/гЙ*=0,68/1,27 0,54 и r?f*/r** =0,73/1,27 0,57 и не соответствует отношение, взятое без учета эффективного атомного радиуса углерода: г/Гр =0,077/0,127 0,61. Необходимо отметить, что для бора, даже с учетом его эффективного атомного радиуса (r** 0,087±0,01 им), при образовании твердого раствора внедрения в железе правило Хэгга не выполняется (rg/Гр =0,68). Такое отношение не позволяет образовать твердые растворы замещения бора в железе. Поэтому можно предположить, что атомы бора внедряются в решетку растворителя по дефектам кристаллического строения (вакансиям, дислокациям, субграницам и границам). Вообще роль дефектов кристаллического строения при образовании твердых растворов может быть значительной, благодаря этому при образовании твердых растворов могут наблюдаться отклонения от размерного фактора. На основании роли размерного фактора для твердых растворов внедрения (г/гме<0,59) и замещения (э ме=0,85-1,15) следует сказать, что отношение атомных размеров в пределах 0,59-0,85 является неблагоприятным для образования твердых растворов. В этом случае, как будет показано ниже, получаются химические соединения со сложной структурой. В твердых растворах внедрения может происходить процесс упорядочения. Наиболее интересный пример такого процесса - упорядочение в железоуглеродистом мартенсите. В мартенсите атомы внедрения (углерод) занимают только октаэдрическне междоузлия о. ц. к. решетки железа. Упорядочение в такой решетке обусловливает появление тетра гональности решетки мартенсита. В о. ц. к. решетке железа можно выделить три о. ц. к. подрешетки со своими направлениями тетрагональностк: [100], [010], [001]. В случае, когда весь углерод расположен только в одной такой подрешетке, мартенсит находится в наиболее упорядоченном состоянии и имеет наибольшую степень тетрагональности. Если же атомы углерода поровну распределены между тремя подрешетг ками, мартенсит вполне неупорядочен и имеет кубическую решетку. Между этими крайними случаями возможны частично упорядоченные состояния. Если бы взаимодействие атомов отсутствовало, то в равновесии атомы углерода были бы распределены равномерно по всем под-решеткам. Из-за наиболее сильной деформации о. ц. к. решетки в направлении [001] при сдвиговом механизме ее образования из г. ц. к. решетки атомы углерода в основном располагаются в окта-порах оси тетрагональности [001], так как именно здесь наблюдается наибольшее деформационное взаимодействие. Параметр дальнего порядка s в мартенсите может изменяться от О до 1. С учетом этого параметра тетрагональность мартенсита с/а может быть выражена в зависимости от атомной доли углерода в мартенсите С следующим выражением: с/а = 1-f 0,0096 Cs. (2> Наибольшая тетратональность мартенсита будет прн полном упорядочении, т. е. при 5=1. Установим охранное оборудование. Тел. . Звоните! |