Установка Видеонаблюдения, Охранной и Пожарной сигнализации.
Звоните! Приедем быстро! Установим качественно! + гарантия 5 лет.
| Тел. 8(901)543-6693 ОАО «Охрана Прогресс» Установка Видеонаблюдения, Охранной и Пожарной сигнализации. Звоните! Приедем быстро! Установим качественно! + гарантия 5 лет. |
||
|
Установка технических средств охраны. Тел. 8(901)543-6693. Звоните! Главная Фазовые превращения стали 1 2 3 4 5 6 7 8 Он понижает обе точки аллотропического превращения железа, но так как точка Л4 снижается быстрее, чем Лз, то обе точки сливаются и у-область замыкается при 13% Сг. Вблизи соотношения Cr:Fe=l : 1 образуется неустойчивое химическое соединение РеСг, обозначаемое обычно как а-фаза. Верхняя температура существования этого соединения равна 815* С. Система железо - молибден (рис. 111.12). Молибден имеет кубическую объемноцентри-рованную решетку, однако атомные размеры то то 1200 1000 доо Ю 20 дО 40 50 60 70 8L
О 10 20 JO 40 SO 60 70 во 90 /00 Fe Si, % Ш Mucce) Si Рис. III. 13. Система железо-кремний молибдена иные, чем у хрома и железа, поэтому молибден образует с а-железом не неограниченный (как хром), а ограниченный ряд твердых растворов. Растворимость молибдена в а-желёзе составляет 5% при 20** С; максимальная растворимость 26% (при 1450°С). Молибден повышает точку Лз и понижает Л4, выклинивая полностью Y-область при 3,5% Мо. Система железо - кремний (рис. III. 13). Кремний имеет кристаллическую решетку алмаза. Растворимость кремния в железе при 20° С составляет 15%. Кремний, повы- шая точку Лз, снижает точку Л4 и полностью выклинивает Y-область при содержании 2%. Следовательно, ферритными являются все сплавы, содержащие более 2% Si (практически >2,5%). Кремний образует с железом ряд соединений - силицидов, условное обозначение которых указано на диаграмме. Растворение легирующих элементов в а-железе происходит в результате замещения атомов железа атомами этих элементов. Атомы легирующих элементов, отличаясь от атомов железа размерами и строением, создают в решетке напряжения, которые вызывают изменение ее периода. Все элементы, растворяющиеся в феррите, изменяют параметры решетки феррита в тем большей степени, чем больше различаются атомные размеры железа и легирующего элемента. Элементы с атомным радиусом, меньшим, чем у железа, уменьшают параметры решетки, а с большим - увеличивают (никель является исключением). Естественно, что изменение размеров а-ре-шетки вызывает и изменение свойств феррита - прочность повышается, а пластичность уменьшается. На рис. П1.14 показаны изменения свойств феррита (твердости, ударной вязкости) при растворении в нем различных элементов. Как видно из диаграмм, хром, молибден, вольфрам упрочняют феррит меньше, чем никель, кремний и марганец. Молибден, вольфрам, а также марганец и кремний (при наличии последних более 1%) снижают вязкость феррита. Хром уменьшает вязкость значительно слабее перечисленных элементов, а никель не снижает вязкости феррита. Существенное значение имеет влияние элементов на порог хладноломкости, что характеризует склонность стали к хрупкому разрушению. Наличие хрома в решетке железа способствует некоторому повышению порога хладноломкости, тогда как никель интенсивно снижает порог хладноломкости, уменьшая тем самым склонность железа к хрупкому разрушению. 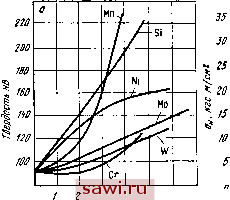 3 5 6 7 1134-56 Содержание ширущего элемента, % Рнс. 111.14. Влияние легирующих элементов на свойства феррита: а - твердость; б - ударную вязкость
Рис. III.15. Периодическая система элементов (рамкой обведены элементы, образующие карбиды в стали) В сталях карбиды образуются только металлами, расположенными в периодической системе элементов левее железа (рис. III. 15). Эти металлы, как и железо, относятся к элементам переходных групп, но имеют менее достроенную d-электронную полосуй Чем левее расположен в периодической системе карбидообразующий элемент, тем менее достроена -его -полоса. Имеется достаточно оснований предполагать, что в процессе карбдообразования углерод отдает свои валентные электроны на заполнение d-электронной полосы атома металла, тогда как у металла валентные электроны образуют металлическую связь, обусловливающую металлические свойства карбидов. Многочисленные опыты показывают, что чем левее в периодической системе расположен элемент, т. е. чем менее достроена у не- * Электроны располагаются вокруг ядра атома в виде отдельных электронных оболочек. Чем дальше от ядра отстоит оболочка, тем выше уровень энергии электронов этой оболочки. Каждая оболочка в свою очередь расщепляется на ряд уровней энергии или полос, получивших обозначения (по направлению от ядра атома) s, р, d, f. На каждой полосе может располагаться ограниченное число электронов. Так, например, на rf-полосе может разместиться не более 10 электронов. При последовательном переходе от атома водорода к другим элементам периодической системы число электронов возрастает з соответствии с их атомным номером, причем электроны сначала занимают все места с наименьшими уровнями энергии, т. е. последовательно все места в первой оболочке, затем во второй и т.д. Однако у некоторых элементов, получивших наименование элементов переходных групп, на внешней (валентной) оболочке уже появляются 1 или 2 электрона еще до того, как достроена f-полоса предыдущей оболочки. К этим элементам относятся многие металлы, в том числ* железо и карбидообразующие элементы. го -электронная полоса, тем более устойчив карбид. Эти обстоятельства позволяют сформулировать положения, характеризующие в общем виде условия карбидообразо-вания в сталях: только металлы с d-элек тронной полосой, заполненной меньше, чем у железа, звляются карбидообразующими; активность их как карбидообразователей тем сильнее и устойчивость образующихся карбидных фаз тем больше, чем менее достроена d-полоса у металлического атома . Это положение позволяет указать условия образования карбидов в стали при наличии нескольких карбидообразующих элементов, последовательность растворения в аустените различных карбидов и другие факторы, важные для теории легирования, практики производства и < применения легированных сталей. В соответствии со сказанным карбиды в сталях будут образовывать следующие элементы: титан, ванадий, хром, марганец, цирконий, ниобий, молибден, гафний, тантал, вольфрам. В природе известны карбиды никеля и кобальта, но в сталях, т. е. в сплавах на основе железа, эти металлы карбидов не образуют, так как на -полосе кобальт имеет 7, а никель 8 электронов, т. е. больше, чем железо, имеющее на -полосе 6 электронов. Поэтому углерод отдает свои электроны железу и карбиды никеля или кобальта не образуются. Элементы с полностью заполненной d-uo-лосой (медь, цинк, серебро и т. д.) ни при Это положение является частным случаем условий образования карбидов или нитридов в сплавах. Карбиде- или нитридообразующим элементом в сплаве является такой элемент, у которого менее достроена d-полоса, чем у основного металла. 8-683 каких условиях карбидов в сплавах не образуют К Вместе с тем в соответствии с высказанным выше положением активность карбидо-образования и устойчивость карбидов в легированных сталях будет возрастать при переходе от элементов марганца и хрома к элементам молибден, ванадий, вольфрам, титан и др., имеющим менее достроенные d-полосы, чем у марганца и хрома. Это значит, например, что при наличии в стали одновременно хрома и ванадия следует ожидать в первую очередь образования карбидов ванадия (в равновесных условиях). Установлено, что в сталях могут образовываться следующие карбидные соединения: РезС, МпзС, Сг2зСб, СгуСз, РезМозС, Pe3W3C - карбиды I группы; М02С, W2C, WC, VC, TiC, NbC, ТаС, ТагС, ZrC - карбиды II группы (фазы внедрения). Однако в сталях в Чистом виде перечисленные карбиды не существуют. Карбиды всех легирующих элементов содержат в растворе железо, а при наличии нескольких карбидообразующих элементов -и эти элементы. Так, в хромомарганцовистой стали вместо чистого карбида хрома СггзСе образуется карбид (Сг, Мп, Ре)2зСб, содержащий в растворе железо и марганец. Так как карбиды, имеющие одинаковую химическую формулу, взаимно растворяются, то, например, при наличии в стали одновременно титана и ниобия будут образовываться не два разделенных вида карбидов, а один общий карбид, в который на равных основаниях входят и титан, и ниобий. Поэтому возможных вариантов карби-дообразования меньше, чем это указано выше, и фактически мы встречаемся в сталях лишь с карбидами шести видов: Л1зС, М?зСб, М7С3, МбС карбиды I группы; МС, М2С- карбиды II группы, где под М подразумевается сумма карбидообразующих элементов (металлических). Соотношения между металлическими элементами и углеродом (для недефектной решетки) указываются формулой. Карбиды, отнесенные в I группу, имеют сложную кристаллическую структуру. Типичным представителем карбидов этого ти-Д1а является цементит. Особенность строения карбидов II группы как фаз внедрения заключается в том, что они имеют простую кристаллическую решетку и кристаллизуются обычно со значительным дефицитом по углероду. Следует отметить, что фзы внедрения трудно растворимы в аустените. Это значит, что при нагреве (даже очень высоком) они могут не перейти в твердый раствор. В этом их отличие от карбидов I группы, которые при нагреве легко растворяются в аустените. Все карбидные фазы обладают высокой температурой плавления и высокой твердостью. Иногда, правда очень редко, в металлических сплавах образуются карбиды бора, алюминия, кремния и других элементов, по приведенной классификации относящихся к некарбидообразу-ющим элементам. Дело в том, что карбиды В4С, AI3C2 и т. д. совершенно отличны от рассматриваемых карбидов Это соединения с кова-лентной связью, не обладающие металлическими свойствами. Фазы внедрения в этом отношении превосходят карбиды I группы. Порядок растворения карбидов в аустените определяется их относительной устойчивостью, а степень перехода в раствор - их количеством. Так, при наличии в сплаве, например, трех карбидов - МуСз, МеС и МС - аустенит сначала будет насыщаться карбидом М7С3 (например, СГ7С3), а карбиды МеС (вольфрама) и МС (ванадия) могут остаться в избытке. Легирующие элементы оказывают существенное влияние на кинетику превращения переохлажденного аустенита. Элементы, которые только растворяются в феррите или цементите, не образуя специальных карбидов, оказывают лишь количественное влияние на процессы превращения. Они или ускоряют превращение (к таким элементам относится только кобальт), или замедляют его (марганец, никель, медь и др.). Карбидообразующие элементы вносят не только количественные, но и качественные изменения в кинетику изотермического превращения аустенита. В сталях, легированных карбидообразующими элементами (хромом, молибденом, вольфрамом), наблюдаются два максимума скорости изотермического распада аустенита, разделенных областью высокой устойчивости переохлажденного аустенита. Изотермический распад аустенита имеет два явно выраженных интервала превращений - превращение в пластинчатые (перлитное) и превращение в игольчатые (бейнитное) структуры. Основные разновидности диаграмм кинетики изотермического превращения аустенита и термокинетических диаграмм распада переохлажденного аустенита представлены на рис. II 1.16. Видно, что в углеродистых и низколегированных сталях температурные интервалы протекания превращений по первой и второй ступеням практически совпадают. На изотермических диаграммах при температурах выше мартенситной точки наблюдается обычно только один кинетический максимум (рис. III.16,а). При температурах выше этого максимума распад аустенита происходит диффузионным путем и сопровождается образованием феррито-кар-бидной смеси (ФКС) различной степени дисперсности. При температурах ниже этого максимума превращение вначале развивается по типу второй ступени, но затем продолжается и заканчивается за счет диффузионного превращения. При распаде доэвтектоидного или заэв-тектоидного аустенита в подобных сталях на изотермических и термокинетических кривых могут появиться дополнительные линии, характеризующие процессы образования избыточных феррита или цементита. В сталях, содержащих заметное количество хрома, молибдена, вольфрама и других элементов, температурные условия протекания превращений по типу первой и второй ступени не совпадают (рис. 111.16,6, г). Повышение устойчивЬсти аустенита под влиянием легирующих элементов особенно заметно при температурах первой ступени и выражается сдвигом соответствующих линий диаграммы вправо. Установим охранное оборудование. Тел. 8(901)543-6693. Звоните! | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||